Hoewel uit theoretisch onderzoek al 25 jaar geleden naar voren kwam dat vloeibaar water bij extreem lage temperatuur en hoge druk mogelijk twee verschijningsvormen heeft, lukte het nog nooit deze voorspelling experimenteel te bevestigen. Onderzoekers van de Universiteit van Amsterdam (UvA) en de Arizona State University (ASU) brengen daar nu verandering in. In ‘Science’ beschrijven ze hoe ze met een antivriesmiddel bij ongeveer -80° C de overgang tussen twee verschillende vloeibare toestanden van onderkoeld water konden waarnemen.
Water gedraagt zich totaal anders dan de meeste andere vloeistoffen. Die krimpen bijvoorbeeld als je ze afkoelt, terwijl water beneden 4° juist uitzet. Ook voor wat betreft de soortelijke warmte en de samendrukbaarheid vertoont water bij afkoeling onverwacht gedrag. Het bevriest bijvoorbeeld niet altijd bij 0°. Om te kunnen bevriezen, moeten watermoleculen ergens een beginnetje van een ijskristal maken. In superschoon water gaat dat heel moeilijk, en dat bevriest daarom pas rond de -40°. Water dat bij temperaturen onder het vriespunt nog vloeibaar is, wordt onderkoeld water genoemd.
Twee vloeibare toestanden
In 1992 suggereerden theoretisch natuurkundigen van Boston University (Verenigde Staten) dat de vreemde eigenschappen van water gerelateerd zouden kunnen zijn aan het bestaan van twee verschillende toestanden (een compacte en minder compacte) van onderkoeld water bij zeer lage temperatuur en hoge druk. We weten dat er bij gewone temperaturen maar één soort water is; volgens de theorie verdwijnt het onderscheid tussen de twee soorten onderkoeld water dan ook boven een bepaalde temperatuur die ver onder de 0° ligt. Het verdwijnen van het onderscheid tussen de twee verschillende vloeistoftoestanden boven deze temperatuur (het zogenaamd kritische punt) zou volgens de theorie de bijzondere eigenschappen van water bij hogere temperaturen verklaren.
De afgelopen jaren hebben computersimulaties en experimenten dit vermoeden versterkt, maar het bleef moeilijk om de twee theoretisch voorspelde vloeibare toestanden ook echt experimenteel waar te nemen. Dat lijkt op het eerste gezicht ook zo goed als onmogelijk: de voorspelde temperatuur waarbij de ene toestand verandert in de andere ligt namelijk ver onder de -40°. Water zal dus altijd bevriezen (vast worden) voordat je de tweede vloeibare verschijningsvorm kunt zien.
Antivries en infrarood
Door een bijzonder soort antivries te gebruiken zijn de onderzoekers van UvA en ASU er nu toch in geslaagd om een toestandsverandering in vloeibaar water waar te nemen bij de extreem lage temperatuur van ongeveer -80° C. De experimenten werden gedaan door Michiel Hilbers, Sander Woutersen (UvA), Zuo-Feng Zhao en Austen Angell (ASU). Om de verandering in vloeistofstructuur vast te stellen, maten Hilbers en Woutersen met infrarood licht de trillingen van de OH-bindingen van watermoleculen. De frequentie van die trillingen is namelijk sterk afhankelijk van de lokale vloeistofstructuur.Aanvankelijk gebruikten de Amsterdammers glycerol als antivries. Dat mengt in principe goed met water en voorkomt zo dat watermoleculen ijskristallen kunnen vormen. Helaas bleek het bij zeer lage temperatuur, net op het moment dat de tweede vloeistoffase zou verschijnen, niet meer goed te werken: dan mengen water en glycerol niet meer goed en verandert de vloeistof in een slush puppie van ijskristalletjes in glycerol. Daarmee leek het onderzoek te zijn gestrand.
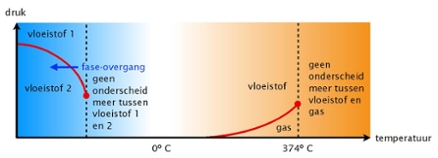 Vereenvoudigd diagram waarin de verschillende niet-kristalvormige toestanden (fasen) van water zijn aangegeven. Afhankelijk van temperatuur en druk is water vloeibaar of gasvormig. Bij temperaturen boven het gas/vloeistof kritische punt (374º C) verdwijnt het onderscheid tussen vloeistof en gas. Voor zeer lage temperatuur worden theoretisch twee vloeibare toestanden voorspeld; bij temperaturen boven het vloeistof1/vloeistof2 kritische punt verdwijnt het onderscheid tussen deze twee vloeistof-toestanden. In het experiment werd tijdens afkoelen de overgang van de ene naar de andere vloeistoftoestand waargenomen (blauwe pijl).
Vereenvoudigd diagram waarin de verschillende niet-kristalvormige toestanden (fasen) van water zijn aangegeven. Afhankelijk van temperatuur en druk is water vloeibaar of gasvormig. Bij temperaturen boven het gas/vloeistof kritische punt (374º C) verdwijnt het onderscheid tussen vloeistof en gas. Voor zeer lage temperatuur worden theoretisch twee vloeibare toestanden voorspeld; bij temperaturen boven het vloeistof1/vloeistof2 kritische punt verdwijnt het onderscheid tussen deze twee vloeistof-toestanden. In het experiment werd tijdens afkoelen de overgang van de ene naar de andere vloeistoftoestand waargenomen (blauwe pijl).
Bezoek aan Amsterdam
De doorbraak kwam toen Woutersen in gesprek raakte met de Amerikaan Austen Angell, die aan de Arizona State University al heel lang aan onderkoeld water werkt. Angell, die in 1971 een sabbatical aan de UvA had gedaan, kwam in de zomervakantie van 2016 een middagje op bezoek op uitnodiging van Daniel Bonn, hoofd van het Van der Waals-Zeeman Instituut van de UvA. Angell suggereerde om een speciaal soort antivries te gebruiken, hydrazinium trifluoracetaat, dat zeer goed mengt met water maar geen noemenswaardige invloed heeft op de waterstructuur, zoals zijn postdoc Zuo-Feng Zhao experimenteel kon aantonen. Computersimulaties van Woutersens collega Bernd Ensing toonden aan dat deze antivriesmoleculen perfect passen in het netwerk van waterstofbruggen in vloeibaar water, en daardoor zelfs bij zeer lage temperaturen het bevriezen van water voorkomen.
Structuurverandering waargenomen
Daarmee werd het lage-temperatuurgebied eindelijk toegankelijk. En zowaar: tijdens het afkoelen zagen de onderzoekers bij een temperatuur van ongeveer -80° een scherpe verandering in de vloeistofstructuur. En wanneer de vloeistof weer werd opgewarmd, veranderde bij diezelfde temperatuur de vloeistofstructuur weer terug. Daarmee lijkt de twee-vloeistof-hypothese voor onderkoeld water, na meer dan 25 jaar, eindelijk experimenteel bevestigd. "Lijkt!", benadrukt Woutersen, "want let wel: dit is water met een flinke scheut antivries erin. Weliswaar antivries die de structuur minimaal verstoort, maar toch. En ik kan niet genoeg benadrukken: bij normale temperaturen, óók onder nul, is er maar één soort water!"




