Een aantal wijzigingen onder de Medical Device Regulation (MDR) en de In Vitro Diagnostics Regulation (IVDR) wordt doorgeschoven naar 2024 of soms zelfs 2028. Tot tevredenheid van FME.
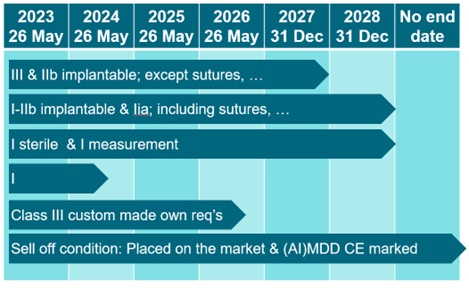
‘We zijn als FME heel blij dat de overgangstermijnen opgeschoven zijn van mei 2024 naar soms zelfs einde 2028. Daar hebben we in samenwerking met de leden hard aan gewerkt om dit met elkaar in Europa voor elkaar te krijgen.’
Veel bedrijven zaten volgens de brancheorganisatie klem vanwege die krappe termijn; met hun medtech-producten en medische hulpmiddelen willen ze graag blijven bijdragen aan goede en patiëntveilige zorg. Met de nieuwe termijnen wordt die mogelijkheid om wel beschikbaar te blijven, een stuk groter.
Waar zat het probleem?
Veel bedrijven hebben producten met certificaten die nog vallen onder de ‘oude’ MDD. Andere bedrijven hebben certificaten die inmiddels verlopen zijn en waarvan hercertificering maar niet lukt. Er zijn ook bedrijven die hun product(en) moeten ‘upgraden’ onder de MDR/IVDR naar een hogere klasse. Daarvoor kregen ze het dossier of de audit niet tijdig rond, en zouden ze dus niet tijdig zijn gecertificeerd. Zonder de verruiming van de termijnen, zouden deze producten niet meer beschikbaar zijn. ‘Die enorme verschraling van het aanbod van een aantal medtech-producten hebben FME en de bedrijven in goede samenwerking met allerlei betrokken partijen gelukkig afgewend.’