Methaan is een bijzonder sterk broeikasgas, en dus is het zaak om er zo weinig mogelijk van naar de atmosfeer te laten ontsnappen. Idealiter wordt het weglekkende gas uit de vele kleinschalige bronnen opgevangen en gebruikt als chemische grondstof.
In Science staat nu beschreven hoe het restmethaan kan worden verwerkt.
Methaan (beter bekend als aardgas) is een bijzonder krachtig broeikasgas. Hoewel het in veel kleinere concentraties voorkomt in de atmosfeer en de uitstoot ervan ook veel lager ligt dan die van CO2, is het verantwoordelijk voor een kwart van de klimaatopwarming.
Methaan komt vooral vrij als restproduct bij de winning en raffinage van aardolie en -gas, bij de verwerking van afval en bij landbouwactiviteiten. Slechts bij een klein deel van deze zogenaamde kleinschalige methaanbronnen wordt het gas opgevangen. Vaak wordt het dan verbrand (of ‘afgefakkeld’ in het geval van olie- en gasinstallaties) waardoor energie wordt opgewekt, maar waarbij ook weer CO2 vrijkomt.
Nochtans is methaan een belangrijke basisgrondstof voor de chemische industrie, van de productie van brandstoffen, oliën en vetten over plastics tot farmaceutica en pesticiden. Vaak wordt het goedje daarvoor eerst omgezet naar methanol, waarbij er aan de methaanmoleculen (CH4) een hydroxylgroep wordt toegevoegd (OH). Die zogeheten hydroxylatiereactie gebeurt onder hoge temperatuur in omvangrijke methanolfabrieken die grote hoeveelheden primair gewonnen aardgas opsouperen. Maar voor het ‘restmethaan’ uit de kleinschalige bronnen is dat geen goede oplossing, aangezien het gas dan eerst over (vaak grote) afstanden moet worden getransporteerd.
Een eveneens kleinschalige, lokale omzetting van restmethaan naar methanol, bij omgevingstemperatuur, geniet daarom de voorkeur. Methanol kan immers wel gemakkelijk worden vervoerd, waarna er in chemische fabrieken nuttige stoffen en materialen van kunnen worden gemaakt.Helaas verloopt die lage-temperatuuromzetting vandaag allesbehalve vlot. Scheikundigen zijn daarom al een tijdlang op zoek naar een katalysator die de reactie kan versnellen en methaan efficiënt omzetten naar methanol. In die zoektocht hebben onderzoekers van de KU Leuven nu een baanbrekende, fundamentele ontdekking gedaan.
Leentjebuur bij de natuur
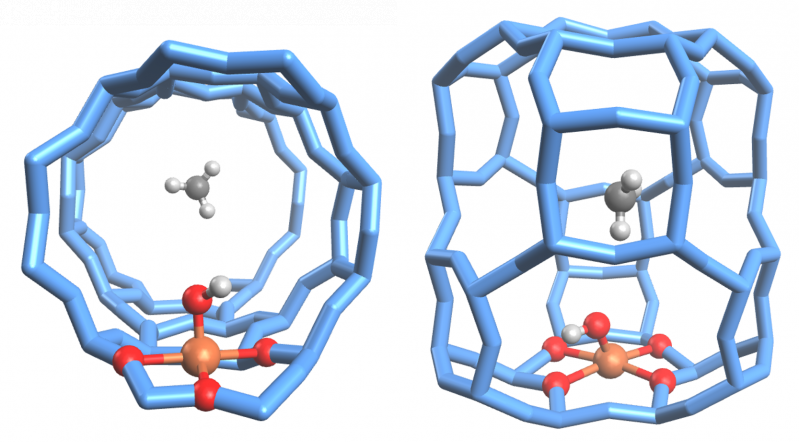
Bij zeolieten, mineralen met microscopisch kleine poriën die al als katalysator in andere industriële processen worden gebruikt, zagen de Leuvense onderzoekers hoe een bijzonder moleculair effect ervoor zorgt dat de stoffen ook vlotjes methaan gaan ‘hydroxyleren’ – zoals de reactie naar methanol heet in chemisch jargon. "In een welbepaalde soort zeoliet sloten we de ijzeratomen (de chemisch actieve componenten) als het ware op in kooitjes", zegt Max Bols van het Departement Microbiële en Moleculaire Systemen. "Zo verhinderden we dat een intermediair reactieproduct kon ontsnappen en daarbij de andere ijzeratomen deactiveren." Precies dankzij dit ‘kooieffect’ bleven alle ijzeratomen in het zeoliet actief, waardoor ze onverminderd methaan naar methanol bleven omzetten.
Voor het kooieffect vonden Bols en zijn collega’s inspiratie in de levende natuur, waar biologische cellen eveneens koolwaterstoffen (zoals methaan) omzetten met behulp van ijzeratomen – en dit bij omgevingstemperatuur. In de cellen belet het effect dat zeer sterk reagerende intermediaire stoffen (radicalen) elders schade aanrichten. Het Leuvense onderzoek kan dus als een mooie vorm van biomimicry worden gezien, waarbij wetenschappers leentjebuur spelen bij de natuur. In dit geval dus door een chemische versnellerstof (een specifiek zeoliet) uit te rusten met een bestaande eigenschap van een enzym (zoals biologische katalysatoren worden genoemd).
De ontdekking is heel fundamenteel, waardoor er nog bijkomend onderzoek nodig is om te komen tot een omzettingsreactie voor methaan naar methanol die ook industrieel kan worden opgeschaald. Maar precies door dat fundamentele karakter kan de vondst ook elders in de katalysatorchemie het onderzoek vooruit stuwen. "Met het kooieffect kunnen we de reactiemechanismen in katalysatoren in het algemeen beter gaan controleren en sturen. Hiermee kunnen we chemische reacties in tal van industriële en milieutoepassingen efficiënter maken", aldus Bols.