Leidse en Eindhovense scheikundigen hebben na decennia de discussie beëindigd over het juiste model voor de eenvoudigste chemische reactie in heterogene katalyse, die essentieel is voor brandstofcellen. Met behulp van een uniek gekromd platinaoppervlak is aangetoond welk model de reactie met waterstof correct beschrijft.
Al bijna vier decennia woedde er in de scheikundige literatuur een heftige discussie: welke van de twee bestaande modellen voor de reactie van waterstof aan een platinakatalysator is juist? Met behulp van traditionele methoden bleek dit niet aan te tonen. De Leidse chemicus Ludo Juurlink besloot met zijn promovendus Richard van Lent en Michael Gleeson van Differ een nieuwe methode te ontwikkelen om sluitend bewijs te leveren, en met succes.
Een trap die steeds smaller wordt
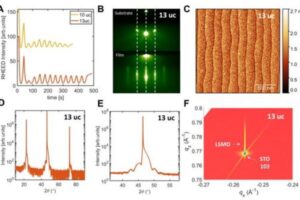
De twee bestaande modellen voor heterogene katalyse geven verschillende voorspellingen over hoe de reactie van waterstof afhangt van de structuur van het platinaoppervlak. Door middel van metingen konden de onderzoekers de reactiviteit van waterstof bepalen en daarmee bewijzen welk model correct is. Hiervoor was het gekromd platinakristal cruciaal, een primeur van een Nederlands bedrijf in Zaandam. "Doordat het platinaoppervlak gekromd is, verloopt de atomaire structuur heel geleidelijk langs het oppervlak", legt Juurlink uit. "Je kunt die structuur vergelijken met een trap, waarvan de treden naar de randen toe steeds smaller worden. In het midden lijkt het meer op een balzaal." Het bleek dat de reactiviteit van waterstof lineair afhankelijk was van hoe dicht de traptreden op elkaar zitten. Hoe verder de traptreden uit elkaar zaten, hoe minder reactief waterstof was. "En daarmee viel het model dat een niet-lineair gedrag voorspelde af."
Unieke mogelijkheid
Het onderzoek werd verricht in hoog vacuüm en levert belangrijke inzichten op. "We weten nu beter hoe we de snelheid van chemische reacties moeten berekenen – één van beide modellen draagt namelijk niet significant bij", zegt Juurlink. "Daarnaast weten we nu dat die gekromde kristaloppervlakken een unieke, nieuwe mogelijkheid bieden om te leren hoe chemische reacties aan oppervlakken daadwerkelijk gebeuren. Daar gaan we zeker meer onderzoek mee doen."
Betere katalysatoren ontwikkelen
Bijna alle grote chemische industriële processen maken gebruik van heterogene katalyse. Katalysatoren zijn soms duur en zeldzaam, zoals platina: een veelgebruikte katalysator die in brandstofcellen en uitlaatsystemen van auto’s zit. "Het aparte is dat we meestal niet eens echt weten hoe en waarom dergelijke katalysatoren chemische reacties versnellen", zegt Juurlink. Beter inzicht in dit hoe en waarom zal bijdragen aan het verduurzamen van de chemische industrie. "Op basis van beter begrip van wat er op atomair niveau gebeurt, kunnen we katalysatoren ontwikkelen die voor minder energieverlies zorgen en minder afhankelijk zijn van dure en zeldzame materialen."
Model niet correct
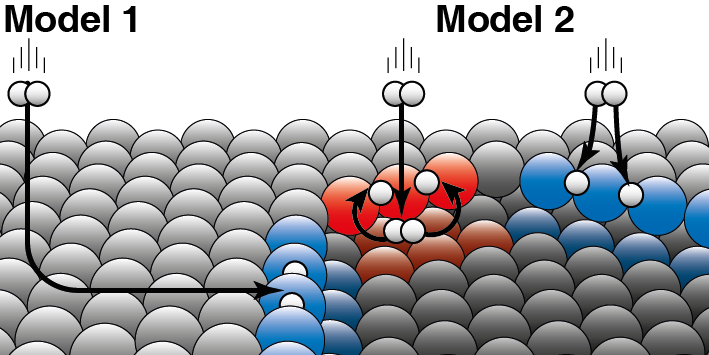
Een katalysator versnelt een chemische reactie zonder daarbij zelf verbruikt te worden. Bij heterogene katalyse is de katalysator meestal een vaste stof en de reactanten een gas of vloeistof. Juurlink legt het verschil tussen de twee modellen uit: "De twee modellen zijn gebaseerd op verschillende aannamen over hoe kinetische energie van het waterstofmolecuul ‘weglekt’ tijdens de botsing met het platinaoppervlak." Ter verduidelijking geeft hij een voorbeeld: "Als een hond in een wak zit, kan hij daar op twee manieren terecht zijn gekomen. Of hij is vanaf de kant over het ijs gegleden en in het wak gevallen, of hij is vanaf de kant direct in het wak gesprongen." Het onderzoek laat nu zien dat waterstofmoleculen voornamelijk direct vanuit het gas aan de traptredenranden van platina reageren. "Het model dat ervanuit gaat dat de meest moleculen over het vlakke platinaoppervlak ‘schaatsend’ bij de randen terecht komen en dan pas reageren is daarom niet correct."