Virussen vermenigvuldigen zich via een proces dat bestaat uit zelfassemblage, rijping van virusdeeltjes en na infectie het vrijlaten van genetisch materiaal in een gastheercel. Nieuw technieken uit de natuurkunde helpen wetenschappers om de dynamiek van deze stappen te bestuderen. Dit kan leiden tot nieuwe behandelingen. Samen met twee collega’s heeft RUG-natuurkundige en ‘fysisch viroloog’ Wouter Roos een overzichtsartikel geschreven dat deze nieuwe technieken belicht.
Het artikel is verschenen in Nature Reviews Physics.
"Natuurkunde is al veel langer in gebruik voor onderzoek aan virussen", zegt Roos. "De wetten van de natuurkunde sturen belangrijke gebeurtenissen in de voortplantingscyclus." Recente ontwikkelingen in natuurkundige technieken maken het mogelijk om zelfassemblage en andere stappen in die cyclus te bestuderen in individuele virusdeeltjes en met een tijdsresolutie van minder dan een seconde. "Die nieuwe technieken laten ons de dynamiek van virussen zien."
In 2010 publiceerdee Roos en twee collega’s al een overzicht van de natuurkundige aspecten van de virologie. "In die tijd was al het onderzoek naar virussen nog voornamelijk statisch, bijvoorbeeld door te kijken wat er gebeurt wanneer je druk uitoefent op een virusdeeltje." Er was wel onderzoek naar dynamische processen zoals zelfassemblage, maar dat gebeurde bij grote aantallen virusdeeltjes tegelijk, zonder de mogelijkheid op een enkel deeltje in te zoomen. "Dat is de laatste jaren veranderd en daarom werd het tijd voor een nieuw overzicht."
Virussen kapen cellen en dwingen ze om eiwitten te maken die als bouwstenen dienen voor nieuwe virusdeeltjes en om hun genetisch materiaal (RNA of DNA) te kopiëren. Het resultaat is een soep vol onderdelen van het virus, die via zelfassemblage nieuwe deeltjes vormen waarin het RNA of DNA zit opgeborgen. "Er is geen externe energie nodig voor dit proces. En zelfs in een reageerbuis kunnen de meeste virussen zichzelf snel opbouwen." Tot voor kort werd dit proces alleen bestudeerd in grote aantallen tegelijk. "We hadden dus geen idee wat de verschillen zijn in de assemblage van individuele virusdeeltjes."
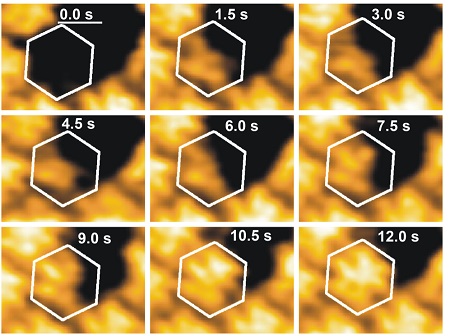
Snelle scans
De afgelopen paar jaar zijn er technieken ontwikkeld om die individuele deeltjes te bestuderen in ‘real time’. Een daarvan is de Atomaire Kracht Microscopie (Atomic Force Microscopy, AFM). Zo’n microscoop scant een oppervlak via een dunne voeler met een punt die enkele atomen groot is. "De snelheid waarmee dat kan is de laatste jaren sterk toegenomen, zodat we nu snelle scans in minder dan een seconde kunnen uitvoeren van oppervlakken tot ongeveer een vierkante micrometer", zegt Roos, die zelf zo’n hogesnelheid AFM gebruikt. "Hiermee kunnen we zien hoe de onderdelen van virussen bij elkaar komen op een oppervlak. Dat is een zeer dynamisch proces, waarbij bouwstenen zich hechten en weer loslaten."
Een andere techniek is het gebruik van fluorescerende moleculen, waarmee bijvoorbeeld de binding van viruseiwit aan DNA is te volgen. "Je kunt met een optische pincet twee kleine bolletjes vasthouden die aan beide uiteinden van het DNA zitten. Als een viruseiwit bindt, zal het DNA zich wat oprollen waardoor de bolletjes dichter bij elkaar komen. Dat kun je volgen via een fluorescerend molecuul op die bolletjes." Ook is het mogelijk om eiwitten te voorzien van een fluorescerende groep waardoor zichtbaar wordt hoe ze zich binden aan virus-DNA of andere eiwitten. Een derde techniek is het gebruik van een optische microscoop waarmee de interferentie van licht dat door virusdeeltjes wordt verstrooid is te meten. De patronen die dit veroorzaakt zeggen iets over de structuur van de deeltjes tijdens de assemblage.
Rijping
Andere stappen in de viruscyclus zijn ook te bestuderen. "Wanneer ze in elkaar zitten, moeten de deeltjes sterk genoeg worden om de omstandigheden buiten de cel te kunnen weerstaan", zegt Roos. Ook andere aanpassingen vinden plaats, die de deeltjes bijvoorbeeld voorbereiden op het infecteren van nieuwe cellen. De dynamiek van deze rijping zijn belangrijk voor ons begrip van hoe de virussen werken. "En nadat ze een nieuwe cel hebben geïnfecteerd moeten ze weer uit elkaar vallen om hun genetisch materiaal af te geven."
Al deze nieuwe technieken onthullen de fysische dynamiek van virussen. Hiermee kunnen wetenschappers bestuderen hoe de deeltjes genetisch materiaal opnemen en welke fysische processen daarbij een rol spelen. De meeste antivirale geneesmiddelen zijn gericht op het blokkeren van de eerste stappen in de infectie, zoals het binden van virusdeeltjes aan een cel. Met de nieuwe dynamische informatie is het mogelijk geneesmiddelen te ontwikkelen die de zelfassemblage verstoren, of andere belangrijke stappen in de reproductiecyclus van virussen. Enkele van de Covid-19 vaccins gebruiken adenovirussen om een gen van het Sars-CoV-2 virus af te leveren in cellen, die het dan omzetten in een eiwit waartegen een afweerreactie wordt opgewekt. "Als we beter begrijpen hoe dat adenovirus in- en uit elkaar gaat zouden we bijvoorbeeld stabielere vaccins kunnen maken."




